阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)为一种临床常见的、累及全身各系统的、反复发生完全或部分上气道阻塞睡眠障碍性疾病,并最终引起间歇性低氧血症伴高碳酸血症及睡眠结构紊乱,促使机体发生一系列病理生理改变的临床综合征。流行病学研究显示呼吸暂停通气不足指数与血压上升呈正相关。在需使用多种降压药联合治疗的OSAHS合并高血压病患者中,持续气道正压通气治疗不仅能显著改善OSAHS患者睡眠呼吸障碍病情,同时能明显控制患者的血压,减少降压药的使用。肠道菌群改变与高血压病发病关系研究的进展及慢性间断缺氧(chronic intermittent hypoxia,CIH)动物模型中肠道菌群改变与高血压病关系的探索,提示了肠道菌群的变化可能是OSAHS患者合并高血压病的重要因素之一。
1、OSAHS与高血压病的关系
目前关于OSAHS与高血压病的内在联系尚不明确。有研究表明,OSAHS患者在睡眠过程中出现的PaO2降低以及高碳酸血症,可分别刺激外周的颈动脉体化学感受器和中枢化学感受器,引起分布于心脏和外周血管的交感神经活性升高。有报道称OSAHS患者在夜间由交感神经支配的肌肉更为活跃,OSAHS患者夜间平均收缩压较对照组高,其夜间收缩压下降较正常人少,血压曲线变化呈非勺状,这可能是由于OSAHS患者夜间交感神经系统较为活跃所致。这些研究显示,交感神经的激活对于OSAHS合并高血压病患者具有重要意义。
此外,OSAHS反复出现CIH可导致氧化应激,并造成血管内壁损伤及结构、功能改变。有研究发现OSAHS患者及OSAHS合并高血压病患者的氧化应激标志物明显升高,而经过持续气道正压通气治疗后,OSAHS合并高血压病患者血压及氧化应激标志物均较前下降。同时临床研究及支气管介入试验也证实了,OSAHS患者在睡眠过程中反复低氧,促进了大量的氧化自由基形成,损伤了血管内皮细胞,造成了类似于心肌梗死的缺血再灌注损伤。CIH所产生的氧化自由基可以通过激活核转录因子κB信号通路、应激活化蛋白激酶信号通路、p38蛋白激酶信号通路等引起全身炎症反应,上调炎性基因的表达,使血液系统中的炎性因子含量明显增加,这些因子通过介导上皮细胞炎性损害,减少舒血管物质,增加缩血管物质的合成,从而增强血管反应性,促进血管重构,增加血管阻力,这些改变最终可能导致了高血压病的发生。
2、高血压与菌群失调的关系
在大量的研究中均发现了高血压患者或动物模型中菌群的显著改变。在中国北方进行的一项临床研究中,研究人员比较了41名健康者[收缩压<125 mmHg(1 mmHg=0.133 kPa)或舒张压<80 mmHg]、56例高血压前期患者(收缩压125~139 mmHg或舒张压80~89 mmHg)和99例高血压患者的肠道菌群,在高血压前期和高血压患者中,肠道菌群的丰度和多样性明显较低,而在高血压患者中普氏菌和克雷伯菌的相对丰度较正常组高。同时,在高血压前期和高血压患者中,产短链脂肪酸(short-chain fatty acids,SCFAs)的菌群,包括伯劳特菌属、罗氏菌属和粪球菌属,较正常组少。同时,高血压及高血压前期组与对照组血浆中相关代谢物亦存在着显著的差异,而在高血压和高血压前期患者中是难以区分的,这在一定程度上提示了肠道菌群的变化可能先于高血压发生。进一步的动物实验发现,在啮齿类动物的高血压模型中存在着显著的肠道菌群改变。其中自发性高血压大鼠(spontaneously hypertensive rat,SHR)的肠道菌群组成与其亲代京都大鼠(Wister Kyoto rat,WKY)相比有显著的不同。与亲代WKY相比,子代SHR的厚壁菌与拟杆菌比值(Firmicutes:Bacteroidetes rate,F/B)增高,但是细菌多样性、丰度及均匀性均较低。同时动物实验证实,产丁酸盐细菌特别是粪球菌属、假丁酸弧菌属在WKY组肠道菌群中的相对丰度高于SHR组;而产乳酸盐细菌如链球菌属和苏黎世杆菌属在SHR组中富集,导致了F/B比值的异常。
3、OSAHS与菌群失调的关系
随着研究的进展,在模拟OSAHS患者的CIH动物模型中,发现了大鼠肠道的菌群改变。在动物实验中,CIH组的大鼠肠内氧气被证实呈梯度变化,肠道中心氧气浓度几乎为0,而肠上皮附近的氧浓度随间断缺氧变化而变化,在距离肠上皮屏障的200 μm范围内反复出现缺氧/复氧的周期性模式。同时,该实验中与对照组相比,CIH组大鼠肠道菌群的丰度及多样性增加了,肠道微生物群与正常菌群相比具有显著差异,厌氧菌丰度在一定程度上增加了,这可能是由于肠内缺氧环境周期出现,有利于专性厌氧菌的生长,从而改变肠道微生物群的构成。此研究同时证实了,CIH能够导致F/B比值的改变,但其变化在动物实验上并没有统计学意义;当CIH与高脂饮食同时存在时,则可导致F/B比值的显著变化,其变化幅度较间断缺氧或是高脂饮食单因素更显著。而F/B比值被认为是肠道菌群失调的标志之一,与肥胖及糖尿病等疾病关系密切。在CIH组的大鼠肠道微生物群中,大量具有黏液降解能力的普氏菌、脱硫弧菌丰度显著增加,提示CIH组的大鼠肠上皮黏液屏障功能减退,产丁酸盐菌,如瘤胃菌科,相对丰度下降。这些肠道菌群的改变提示在OSAHS患者中肠道菌群失调与高血压病的发生和发展可能存在潜在的关联。
4、OSAHS与高血压病及肠道菌群的联系
如上述各类研究显示,OSAHS与高血压病患者皆存在肠道菌群的变化,虽尚无进一步的研究,但其中有着显著的相似点。
产乳酸盐菌群的富集导致机体乳酸盐的增多,乳酸盐能够促进脂多糖(lipopolysaccharide,LPS)刺激的炎症因子IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和IL-1等的表达。与此同时,肠道菌群失调导致产LPS菌群的增多,LPS是由细菌特异性多糖、非特异性核心多糖和脂质A3部分由共价键相连组成的,其中脂质A作为一种内毒素的主要毒性成分,有着诱发炎症、免疫反应的能力。大量LPS能够以核转录因子κB通路为主要通路,释放细胞因子,如一氧化氮、TNF-α、IL-1、IL-6、干扰素、IL-8等,这些细胞因子的释放可能导致OSAHS患者全身炎症反应的产生。
OSAHS患者中肠道菌群失调所致的黏液降解细菌数量的增加,细菌降解黏液蛋白的过程也常被认为是疾病的初始阶段,可能参与了肠上皮黏液屏障功能减退,降低了肠道黏液屏障的保护功能,这可能会导致肠道细菌的迁移及肠炎的发生,亦可导致全身性炎症的产生,使得肠内渗透性增加,通过增加渗透性和细菌的易位,并破坏肠黏膜上皮细胞结合的完整性,直接影响细胞的功能,促进肠道及全身炎症的产生。而低水平的全身炎症几乎存在于高血压的所有形式和模型中,在高血压病的发展和发病机制中起着关键作用,能够造成血管内皮细胞的损伤,促使血管重构,从而可能导致了高血压病的发生。
此外,肠道菌群失调所致SCFAs减少也可能是血压升高的因素之一。在肾脏中发现SCFAs受体G蛋白偶联受体olfactory受体78(Olfr78)被认为参与了血压的调控。在肾脏的血管平滑肌上发现Olfr78能够结合醋酸酯和丙酸酯,从而调节肾素的释放。Olfr78缺陷小鼠血压在丙酸酯治疗下可短暂下降。此外,SCFAs对于炎性反应有一定的抑制作用。SCFAs能通过GPR41和GPR43受体经组蛋白脱乙酰基酶抑制途径,减少TNF-α、IL-2、IL-6蛋白释放,亦可通过抑制核转录因子κB、p38蛋白激酶信号通路等减少白细胞的黏附,同时也可抑制由LPS介导的中性粒细胞中细胞因子诱导的化学引诱物-2αβ和一氧化氮的产生,具有重要的抗炎作用。SCFAs也能促进肠道黏膜的修复,当肠道内SCFAs的产量降低时,会抑制上皮细胞的增殖水平。大鼠结肠灌注乙酸、丙酸和丁酸时,能显著刺激空肠和结肠上皮细胞的增殖。
最后,亦有一些研究认为SCFAs是活性氧的抑制剂,能够在一定程度上降低氧化应激反应。无论是促进肠道黏膜的修复或是抑制炎症的产生,SCFAs都起到了重要作用,而其产量的减少导致抗炎能力的下降,全身炎症的发生,可能与高血压病发病相关。综合以上,整理出OSAHS合并高血压病发生发展过程可能机制(图1)。
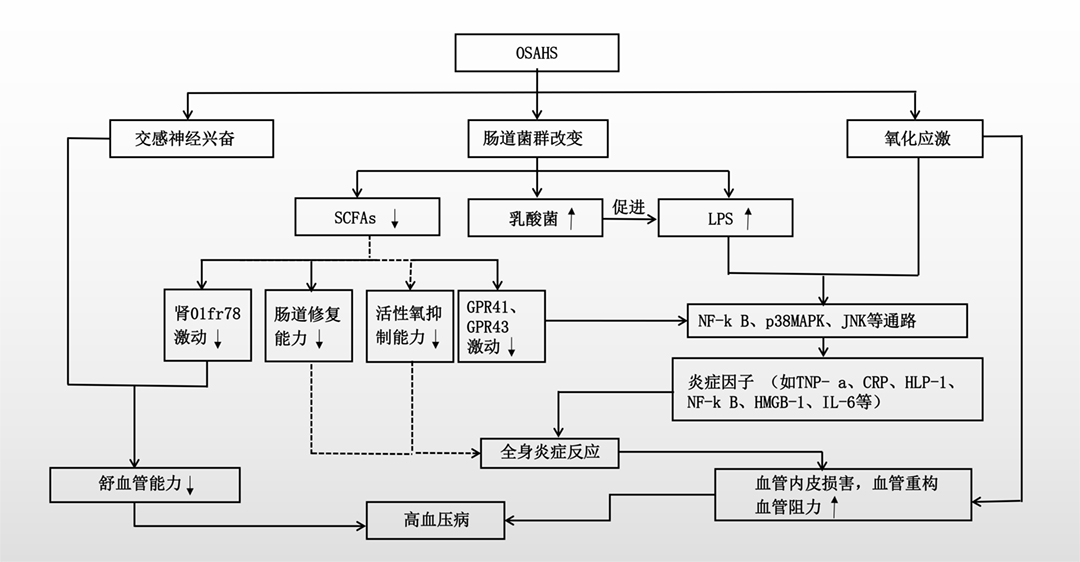
图1 肠道菌群改变在OSAHS与高血压病之间可能的关系及机制
OSAHS作为心血管疾病的独立危险因素,与高血压病的发生关系密切。OSAHS可能通过改变肠道菌群,减少SCFAs的产量,增加乳酸盐及LPS产量,并与交感神经的兴奋及氧化应激的增强协同作用,从而导致肾脏血管舒血管能力下降、全身炎症反应的增加,从而最终引起高血压病的产生和进展。
参考文献:[1]苏焕章, 胡安可, 柯智元,等. OSAHS合并高血压病与肠道菌群失调机制[J]. 国际呼吸杂志, 2020, 40(24):5.





